El corazón fue identificado como una fuente importante de émbolos hacia el cerebro desde que Gowers en 1875 describió un caso de oclusión embolica de la arteria cerebral media y la arteria oftálmica. Desde entonces importantes progresos se han realizado en la prevención, diagnóstico y tratamiento de esta importante y potencialmente prevenible causa de infarto cerebral. El siguiente trabajo resume el estado actual de los aspectos médicos del infarto cerebral cardioembólico.
De acuerdo a la clasificación TOAST (Trial of Org 10172 in Acute Stroke Treatment) (1) el infarto cerebral cardioembólico es aquel en el que la oclusión arterial se presume debida a un embolo que se origina del corazón. Por lo menos una fuente de émbolos cardiaca debe ser identificada para el diagnóstico de infarto cerebral cardioembólico. Las fuentes cardiacas están divididas en grupos de riesgo medio y alto dependiendo de su relativa propensión a embolizar. El diagnostico puede ser posible o probable dependiendo de los hallazgos en los exámenes complementarios.
La frecuencia en registros hospitalarios de infarto cerebral utilizando la clasificación TOAST varía entre el 9% (2) y el 38% (3). En general se considera que el 20% de los infartos cerebrales son de etiología cardiaca. (4)
La tabla 1 muestra las distintas fuentes cardiacas de acuerdo a su riesgo embolígeno. (5)
Tabla 1. Fuentes de embolismo cardiaco de acuerdo a su riesgo embolígeno.
| Riesgo Alto | Riesgo Medio |
|---|---|
| Válvula Mecánica Protésica | Prolapso de la Válvula Mitral |
| Estenosis Mitral con Fibrilación Auricular | Calcificación del Anillo Mitral |
| Fibrilación Auricular (no solitaria) | Estenosis Mitral Sin Fibrilación Auricular |
| Trombo auricular izquierdo | Turbulencia Atrial Izquierda |
| Síndrome del Seno Enfermo | Aneurisma del Septo Auricular |
| Infarto Miocárdico <4 semanas | Foramen Oval Permeable |
| Trombo ventricular izquierdo | Fluter Auricular |
| Cardiomiopatía Dilatada | Fibrilación Auricular Solitaria |
| Segmento Acinético ventricular izquierdo | Válvula Cardiaca Bioprotésica |
| Mixoma Auricular | Endocarditis Trombótica No bacteriana |
| Endocarditis Infecciosa | Falla Cardiaca Congestiva |
| Segmento Hipo cinético Ventricular Izquierdo | |
| Infarto Miocárdico >4 semanas, < 6 meses |
Existe historia de fibrilación auricular no valvular en cerca del 50% de los pacientes, la enfermedad valvular cardiaca está presente en entre el 15 y el 25%. Un trombo intraventricular izquierdo se logra identificar hasta en el 30-35% de los casos. (6)
Mediante el uso de la escala de valoración del infarto cerebral de los Institutos Nacionales de Salud de los Estados Unidos (NIHSS) (7), se ha determinado que 4 de sus ítems tienen el mayor valor predictivo para infarto cardioembólico a saber: afasia, negligencia, alteración del campo visual y paresia braquial. Cuando ninguno de los 4 está presente la probabilidad de infarto cardioembólico es de solo 10%, mientras que cuando los 4 están presentes la probabilidad es del 39%. (8) Otros datos clínicos altamente sugestivos son: inicio súbito a un déficit máximo (<5 minutos) presente en el 47-74% de los casos y alteración del estado de alerta (19-31%). (9) Hallazgos más raros pero de tomarse en cuenta son: mejoría dramática de un déficit neurológico mayor en la evaluación inicial (en relación con la migración distal de un embolo seguido por recanalización del vaso inicialmente ocluido) y presencia de afasia sin hemiparesia. (10)
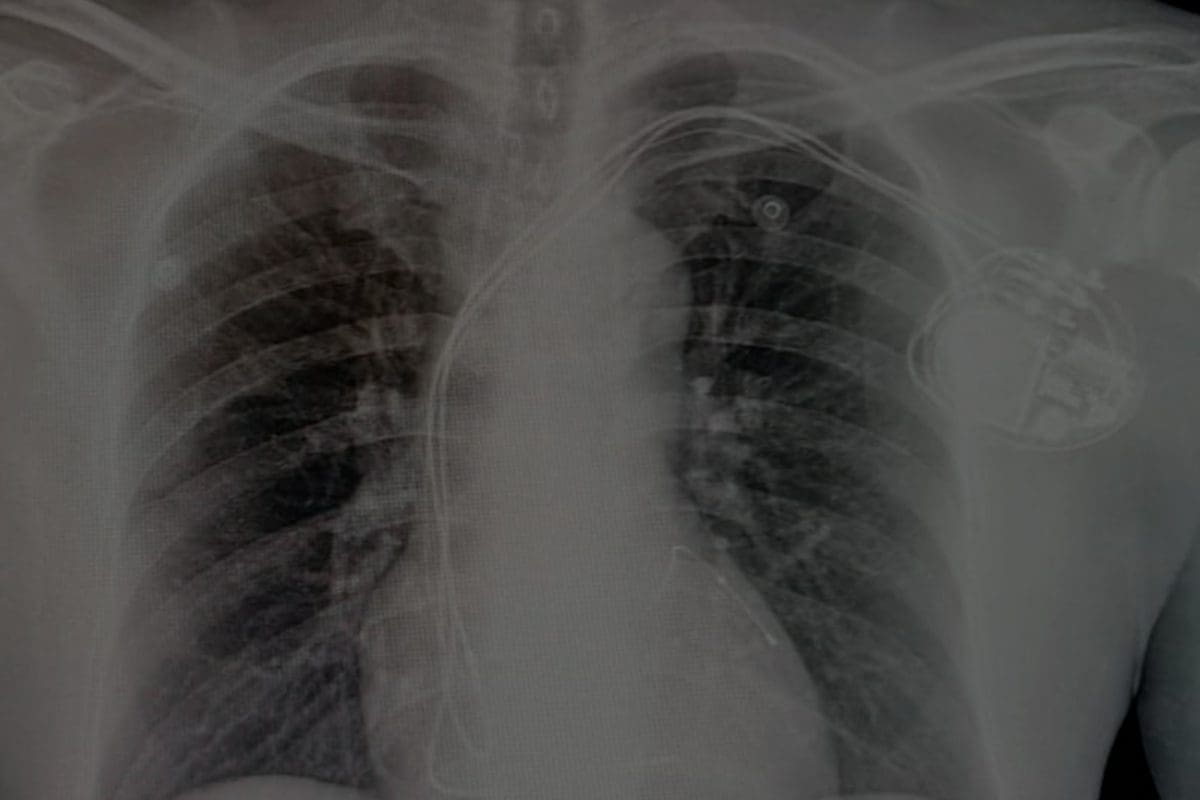
Los hallazgos de utilidad en la sospecha de infarto cardioembólico dependen de la modalidad de imagen utilizada; en general se considera que la multiplicidad en espacio (varios eventos isquémicos en distintos territorios vasculares) y la multiplicidad en tiempo (infartos de diferente edad) son los dos datos más importantes. El signo de la arteria cerebral media híperdensa (Figura 1) puede sugerir el diagnostico pero se requiere de la ausencia de enfermedad carotidea, lo mismo aplica para la recanalización rápida de una arteria cerebral mayor observada en estudios seriados como angiografía cerebral o angio-tomografía. (11)
No existe un estándar dorado para el diagnóstico, sin embargo ante la presencia de un cuadro clínico y hallazgos de imagen compatibles, el diagnostico de infarto cerebral cardioembólico probable se basa en 2 parámetros: a) la exclusión de fuentes de trombosis o embolismo a partir de ateroesclerosis de grandes arterias y b) la evidencia por estudios auxiliares de una fuente embolígena cardiaca. En los pacientes con fuentes embolígenas de riesgo medio sin evidencia de otro origen del infarto, el diagnóstico es de infarto cerebral cardioembólico posible. (1)
Los estudios auxiliares a realizar en un paciente con sospecha de Infarto Cerebral Cardioembólico se dividen en aquellos que se deben realizar: a) a todo paciente con infarto cerebral (electrocardiograma estándar); b) en la mayoría de los pacientes (Ecocardiograma transtoráccico y electrocardiograma de 24 a 48 horas) y c) sólo en pacientes seleccionados (monitoreo Holter, Ecocardiograma transesofágico y estudios electrofisiológicos) (12)
Cuando la sospecha de cardioembolismo es alta y se requiere evaluar ambas aurículas, se busca un aneurisma del septo o se requiere examinar la aorta torácica, se prefiere el ecocardiograma transesofágico. (13)
La transformación hemorrágica se refiere a la presencia de sangrado dentro del parénquima cerebral usualmente limitado al territorio previamente infartado (Figura 2). (14) Entre el 20 y 40% de los pacientes con infarto cerebral experimentan transformación hemorrágica dentro de la primer semana de inicio de los síntomas (15), en el caso del cardioembolismo este porcentaje alcanza el 71%. (16)

Figura 2. Tomografía Axial Computada en cortes coronales que muestra la transformación hemorragica de un infarto en el territorio de la arteria cerebralmedia izquierda.
El riesgo de recurrencia temprana para cualquier tipo de infarto cerebral varía entre el 1 y el 10%. (17) Sin embargo, algunos estudios han demostrado que la recurrencia es mayor en pacientes con infarto cardioembólico en comparación con los otros subtipos de infartos. El riesgo de recurrencia de un infarto cardioembólico se estima entre el 1 y el 22% dependiendo de la patología cardiaca de base siendo el promedio de 12%. (18)
Los infartos cardioembólicos son el subgrupo de infarto cerebral con la más alta mortalidad hospitalaria durante la fase aguda del evento (20-30%). La mortalidad asociada a la recurrencia del evento es aún más alta alcanzando el 77%. (9) La neumonía, la tromboembolia pulmonar, la sepsis y la recurrencia de embolismo contribuyen con aproximadamente el 50% de las muertes, mientras que la herniación cerebral, la transformación hemorrágica y otras causas neurológicas explican la otra mitad.
En la actualidad no existe ningún biomarcador que guie el diagnostico ni la clasificación de los infartos cerebrales, sin embargo este campo constituye un área de intensa investigación, entre los marcadores que han mostrado mayor especificidad para el diagnóstico de infarto de origen cardiaco se encuentran las proteínas BNP (Péptido Natriurético Cerebral) y el dímero D, y los genes PITX2 y ZFHX3. (19) Pese a que existen múltiples biomarcadores además de los mencionados anteriormente que han sido exitosamente asociados con el diagnóstico, etiología o pronostico del infarto cerebral, la información con respecto a su utilidad clínica es extremadamente limitada, debido a la escasez de ensayos clínicos rigurosos que validen su uso.
Las técnicas epicárdicas o endovasculares para el cierre del apéndice auricular izquierdo o del foramen oval, están siendo actualmente exploradas como una alternativa para disminuir la necesidad de anticoagulación o como terapia de primera línea para reducir el riesgo de infarto cerebral cardioembólico. Dispositivos como el WATCHMAN (Atritech, Plymouth, MN), el PLAATO (ev3, Plymouth, MN); y el Amplatzer Cardiac Plug (AGA Medical, Golden Valley, MN) han sido evaluados en estudios aleatorizados como terapias alternativas a la anticoagulación farmacológica, (20-22) llegando incluso a comprobar no inferioridad con respecto a la warfarina (21), no obstante, aspectos como la necesidad de entrenamiento altamente especializado para su colocación y las dudas con respecto a la incidencia de complicaciones, han prevenido a instancias reguladoras como la FDA de permitir su uso extendido. (23)
Los antagonistas de la vitamina K tienen algunas incomodidades como las múltiples interacciones con alimentos y medicamentos y el hecho de requerir monitoreo por laboratorio frecuente que limitan su uso en la práctica clínica, y cuando son utilizados, las tasas de abandono del tratamiento son altas. (24) Además, muchos de los pacientes que reciben antagonistas de vitamina K no alcanzan niveles adecuados de anticoagulación. (25) Estos aspectos justificaron la búsqueda de nuevos compuestos encaminados a sustituir el uso de los anticoagulantes orales más antiguos. Actualmente se cuenta con dos compuestos que tienen un adecuado nivel de evidencia para substituir la anticoagulación con antagonistas de la vitamina k: El dabigatran y el rivaroxaban.
El etexilato de dabigatran es un pro fármaco oral que es rápidamente convertido a dabigatran, un inhibidor competitivo de la trombina. Su vida media es de 12 a 17 horas con una biodisponibilidad de 6.5% y excreción renal. En el estudio RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) se comparó de forma aleatorizada y ciega, el uso de dabigatran en dosis de 110 y 150mg dos veces al día con la warfarina. (26) Los resultados mostraron que en pacientes con fibrilación auricular, el dabigatran en dosis de 110mg se asoció con tasas de infarto similares a las de la warfarina, así como a tasas más bajas de hemorragia intracerebral.
El rivaroxaban, es un potente inhibidor oral del factor Xa, su actividad dura 24 horas lo que permite su administración una sola vez al día, con un pico de efecto a las 4 horas post ingesta. El estudio ROCKET AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) estudió de forma aleatorizada y ciega el efecto de 20mg de rivaroxaban comparado con warfarina. (27) Este estudio demostró que en pacientes con fibrilación auricular, el rivaroxaban no fue inferior a la warfarina para la prevención de infarto cerebral o embolismo sistémico, con una menor incidencia de sangrado intracraneal y fatal. Actualmente este fármaco está en espera de su autorización por la FDA para permitir su uso extendido como alternativa a la warfarina. Otros fármacos inhibidores del factor X actualmente en estudio incluyen al apixaban, betrixaban, LY517717, YM150 y el DU-176b. (28)
En base a la evidencia anterior, múltiples organizaciones como la Asociación Americana del Corazón, la Fundación del Colegio Americano del Corazón y la Sociedad del Ritmo del Corazón entre otras han decidido modificar sus lineamientos de práctica clínica para recomendar el uso de dabigatran como alternativa a la warfarina en la prevención del infarto cerebral cardioembólico. (29)
Los anticoagulantes orales antagonistas de la vitamina K y los anti plaquetarios son los pilares del tratamiento de esta patología. La elección del fármaco a utilizar depende de varios factores, entre ellos, la tasa de riesgo de infarto asociado con cada fuente embolígena, el riesgo-beneficio de cada terapia y las preferencias de cada paciente. La Tabla 2 muestra las recomendaciones generales de acuerdo a cada fuente embolígena.
Tabla 2. Tratamiento para la prevención del infarto cerebral cardioembólico en diferentes condiciones cardiacas. Tomado de Referencia (12)
| Condición | Terapia recomendada | Evidencia |
|---|---|---|
| Prevención Primaria: Alto Riesgo | Anticoagulación Oral INR 2-3 | A |
| Prevención Primaria: Riesgo Medio | Anticoagulación Oral INR 1.8-2.5 | A |
| Prevención Primaria: Riesgo Bajo | Aspirina o ninguno | A |
| Cardioversión Electiva | Heparina seguida de Anticoagulación Oral | A |
| Cardioversión Aguda | Anticoagulación Oral por 3 semanas previas y 4 posteriores | A |
| Prevención Secundaria | Anticoagulación Oral INR 2-4 | A |
| Infarto Miocárdico- Sin embolismo previo- Con falla cardiaca congestiva
– Aneurisma ventricular – Trombo móvil |
AspirinaAspirina o Anticoagulación Oral
Aspirina Anticoagulación Oral |
AC
C C |
| Válvulas Mecánicas | Anticoagulación Oral con o sin aspirina | A |
| Válvulas Bio-protésicas | Anticoagulación Oral | C |
| Estenosis Mitral Reumática | Anticoagulación Oral y Cirugía | C |
| Síndrome del Seno Enfermo | Anticoagulación Oral y Marcapaso | C |
| Flutter Auricular | Anticoagulación Oral | A |
| Miocardiopatía Dilatada | Anticoagulación Oral | C |
| Trombo Auricular | Anticoagulación Oral | C |
| Trombo Ventricular | Anticoagulación Oral | C |
| Pared Ventricular Hipo/Acinética | Anticoagulación Oral | C |
| Endocarditis Infecciosa- Válvula nativa- Válvula mecánica
– Válvula mecánica con infarto grande |
AntibióticosAntibióticos y Anticoagulación Oral
Suspender Anticoagulación Oral y Cirugía |
CC
C |
| Aneurisma del Septum Auricular (ASA) | Aspirina o ninguno | C |
| Foramen Oval Permeable (FOP) | Aspirina | A |
| ASA + FOP | Aspirina ó Aspirina + Clopidogrel | C |
Niveles de Evidencia: A) Estudios aleatorizados y controlados o Meta análisis. B) Otros estudios aleatorizados. C) Series de Casos, estudios observacionales, consensos u opiniones de expertos.
La Fibrilación Auricular es el trastorno del ritmo cardiaco más frecuente. Esta condición acarrea un riesgo alto de embolismo e infarto cerebral. La elección de la modalidad de tratamiento se debe realizar de forma individualizada basándose en la edad el paciente, sus comorbilidades y las contraindicaciones del tratamiento a utilizar. Los lineamientos actuales (29) recomiendan que los pacientes en la categoría de riesgo alto deben recibir warfarina y aquellos con riesgo bajo aspirina. Con el propósito de determinar la categoría de riesgo a la que pertenece cada paciente se han desarrollado más de 15 esquemas de estratificación de riesgo, (30) de entre los cuales las más utilizadas son la escala CHADS 2 y la CHA2DS2-VASc ya que han probado un excelente poder predictivo en grandes cohortes seleccionadas. Tabla 3 y 4.
Tabla 3. La Escala CHA2DS2-VASc
| Parámetro de la Escala | Puntuación | Tasas de Infarto Anual ajustadas. (31) | Recomendaciones de Tratamiento | ||
|---|---|---|---|---|---|
| Parámetro de la Escala | Puntuación | Tasas de Infarto Anual ajustadas. (31) | Recomendaciones de Tratamiento | ||
| C | Insuficiencia cardíaca o disfunción VI | 1 punto | Puntuación CHA2DS2-VASc | (%/año) | Anticoagulación:CHA2DS2-VASc > o = 2
AAS o anticoagulación (preferible anticoagulación): CHA2DS2-VASc = 1 Nada o AAS (preferible nada): CHA2DS2-VASc = 0 |
| H | Hipertensión Arterial | 1 punto | 0-2 | 2.2 | |
| A | Edad ≥ 75años | 2 puntos | 3 | 3.2 | |
| D | D: DM | 1 punto | 4 | 4.0 | |
| S | Infarto Cerebral, AIT o tromboembolismo | 2 puntos | 5 | 6.7 | |
| V | Vasculopatía (Infarto Miocárdico previo, arteriosclerosis aórtica o arteriopatía periférica) | 1 punto | 6 | 9.8 | |
| A | Edad 65-74 años | 1 punto | 7 | 9.6 | |
| Sc | Sexo Mujer | 1 punto | 8 | 6.7 | |
| 9 | 15.2 | ||||
Tabla 4. La Escala CHADS2
| Parámetro de la Escala | Puntuación | Tasas de Infarto Anual ajustadas. (32) | Recomendaciones de Tratamiento | ||
|---|---|---|---|---|---|
| Parámetro de la Escala | Puntuación | Tasas de Infarto Anual ajustadas. (32) | Recomendaciones de Tratamiento | ||
| C | Insuficiencia cardíaca o disfunción VI | 1 punto | Puntuación CHADS2 | (%/año) | Anticoagulación INR 2-3:CHADS2 > o = 2
AAS o anticoagulación (preferible anticoagulación): CHADS2 = 1 AAS : CHA2DS2-VASc = 0 |
| H | Hipertensión Arterial | 1 punto | 0 | 1.9 | |
| A | Edad ≥ 75años | 1 puntos | 1 | 2.8 | |
| D | D: DM | 1 punto | 2 | 4.0 | |
| S2 | Infarto Cerebral ó AIT | 2 puntos | 3 | 5.9 | |
| 4 | 8.5 | ||||
| 5 | 12.5 | ||||
| 6 | 18.2 | ||||
- Adams HP, Jr., Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke; a journal of cerebral circulation. 1993;24(1):35-41. Epub 1993/01/01.
- Lee BC, Hwang SH, Jung S, Yu KH, Lee JH, Cho SJ, et al. The Hallym Stroke Registry: a web-based stroke data bank with an analysis of 1,654 consecutive patients with acute stroke. European neurology. 2005;54(2):81-7. Epub 2005/09/13.
- Vemmos KN, Takis CE, Georgilis K, Zakopoulos NA, Lekakis JP, Papamichael CM, et al. The Athens stroke registry: results of a five-year hospital-based study. Cerebrovasc Dis. 2000;10(2):133-41. Epub 2000/02/25.
- Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke; a journal of cerebral circulation. 2006;37(2):577-617. Epub 2006/01/25.
- Stroke–1989. Recommendations on stroke prevention, diagnosis, and therapy. Report of the WHO Task Force on Stroke and other Cerebrovascular Disorders. Stroke; a journal of cerebral circulation. 1989;20(10):1407-31. Epub 1989/10/01.
- Cardiogenic brain embolism. The second report of the Cerebral Embolism Task Force. Archives of neurology. 1989;46(7):727-43. Epub 1989/07/01.
- Brott T, Adams HP, Jr., Olinger CP, Marler JR, Barsan WG, Biller J, et al. Measurements of acute cerebral infarction: a clinical examination scale. Stroke; a journal of cerebral circulation. 1989;20(7):864-70. Epub 1989/07/01.
- Leira EC, Adams HP, Jr., Rosenthal GE, Torner JC. Baseline NIH stroke scale responses estimate the probability of each particular stroke subtype. Cerebrovasc Dis. 2008;26(6):573-7. Epub 2008/10/24.
- Arboix A, Alio J. Cardioembolic stroke: clinical features, specific cardiac disorders and prognosis. Current cardiology reviews. 2010;6(3):150-61. Epub 2011/08/02.
- Palacio S, Hart RG. Neurologic manifestations of cardiogenic embolism: an update. Neurologic clinics. 2002;20(1):179-93, vii. Epub 2002/01/05.
- Ringelstein EB, Koschorke S, Holling A, Thron A, Lambertz H, Minale C. Computed tomographic patterns of proven embolic brain infarctions. Annals of neurology. 1989;26(6):759-65. Epub 1989/12/01.
- Ferro JM. Cardioembolic stroke: an update. The Lancet Neurology. 2003;2(3):177-88.
- Pepi M, Evangelista A, Nihoyannopoulos P, Flachskampf FA, Athanassopoulos G, Colonna P, et al. Recommendations for echocardiography use in the diagnosis and management of cardiac sources of embolism: European Association of Echocardiography (EAE) (a registered branch of the ESC). European journal of echocardiography : the journal of the Working Group on Echocardiography of the European Society of Cardiology. 2010;11(6):461-76. Epub 2010/08/13.
- Hamann GF, del Zoppo GJ, von Kummer R. Hemorrhagic transformation of cerebral infarction–possible mechanisms. Thrombosis and haemostasis. 1999;82 Suppl 1:92-4. Epub 2000/03/01.
- Moulin T, Crepin-Leblond T, Chopard JL, Bogousslavsky J. Hemorrhagic infarcts. European neurology. 1994;34(2):64-77. Epub 1994/01/01.
- Jorgensen L, Torvik A. Ischaemic cerebrovascular diseases in an autopsy series. 2. Prevalence, location, pathogenesis, and clinical course of cerebral infarcts. Journal of the neurological sciences. 1969;9(2):285-320. Epub 1969/09/01.
- Hornig CR, Brainin M, Mast H. Cardioembolic stroke: results from three current stroke data banks. Neuroepidemiology. 1994;13(6):318-23. Epub 1994/01/01.
- Cardiogenic brain embolism. Cerebral Embolism Task Force. Archives of neurology. 1986;43(1):71-84. Epub 1986/01/01.
- Garcia-Berrocoso T, Fernandez-Cadenas I, Delgado P, Rosell A, Montaner J. Blood biomarkers in cardioembolic stroke. Current cardiology reviews. 2010;6(3):194-201. Epub 2011/08/02.
- Park JW, Leithauser B, Gerk U, Vrsansky M, Jung F. Percutaneous left atrial appendage transcatheter occlusion (PLAATO) for stroke prevention in atrial fibrillation: 2-year outcomes. The Journal of invasive cardiology. 2009;21(9):446-50. Epub 2009/09/04.
- Holmes DR, Reddy VY, Turi ZG, Doshi SK, Sievert H, Buchbinder M, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet. 2009;374(9689):534-42. Epub 2009/08/18.
- Rodes-Cabau J, Champagne J, Bernier M. Transcatheter closure of the left atrial appendage: initial experience with the Amplatzer cardiac plug device. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions. 2010;76(2):186-92. Epub 2010/07/29.
- Fuller CJ, Reisman M. Stroke prevention in atrial fibrillation: atrial appendage closure. Current cardiology reports. 2011;13(2):159-66. Epub 2011/01/13.
- Hylek EM, Evans-Molina C, Shea C, Henault LE, Regan S. Major hemorrhage and tolerability of warfarin in the first year of therapy among elderly patients with atrial fibrillation. Circulation. 2007;115(21):2689-96. Epub 2007/05/23.
- Connolly SJ, Pogue J, Eikelboom J, Flaker G, Commerford P, Franzosi MG, et al. Benefit of oral anticoagulant over antiplatelet therapy in atrial fibrillation depends on the quality of international normalized ratio control achieved by centers and countries as measured by time in therapeutic range. Circulation. 2008;118(20):2029-37. Epub 2008/10/29.
- Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. The New England journal of medicine. 2009;361(12):1139-51. Epub 2009/09/01.
- Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. The New England journal of medicine. 2011;365(10):883-91. Epub 2011/08/13.
- Turpie AG. New oral anticoagulants in atrial fibrillation. European heart journal. 2008;29(2):155-65. Epub 2007/12/22.
- Wann LS, Curtis AB, Ellenbogen KA, Estes NA, 3rd, Ezekowitz MD, Jackman WM, et al. 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (update on Dabigatran): a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation. 2011;123(10):1144-50. Epub 2011/02/16.
- Van Staa TP, Setakis E, Di Tanna GL, Lane DA, Lip GY. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice. Journal of thrombosis and haemostasis : JTH. 2011;9(1):39-48. Epub 2010/10/30.
- Olesen JB, Lip GY, Hansen ML, Hansen PR, Tolstrup JS, Lindhardsen J, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ. 2011;342:d124. Epub 2011/02/02.
- Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA : the journal of the American Medical Association. 2001;285(22):2864-70. Epub 2001/06/13.