Sociedad Interamericana de Cardiología (CIFACAH-ELECTROSIAC)/Sociedad Latinoamericana de Ritmo Cardiaco (LAHRS): revisión multidisciplinaria sobre el uso apropiado de la terapia de resincronización cardiaca en la insuficiencia cardiaca
Interamerican Society of Cardiology (CIFACAH – ELECTROSIAC)/Latin American Heart Rhythm Society (LAHRS): multidisciplinary review on the appropriate use of cardiac resynchronization therapy in heart failure
Juan E. Gómez Mesa1,2,3,4*, Manlio F. Márquez4,5,6, Marcio Figueiredo7,8, Ana Berni4,6,9, Ana Jerez3,4,10, Elaine Núñez3,4,11, Freddy Pow-Chon3,4,12, Luis F. Pava-Molano1,8, María C. Montes13, Stephania Galindo-Coral13, Raúl Garillo2,4,6, Walter Reyes Caorsi4,6,14 y Mario Speranza15 1Departamento de Cardiología, Fundación Valle del Lili, Cali, Colombia; 2Facultad de Ciencias Médicas, Pontificia Universidad Católica Argentina, Buenos Aires, Argentina; 3
Departamento de Cardiología, Consejo Interamericano de Insuficiencia Cardiaca e Hipertensión Pulmonar, Ciudad de México, México; 4Departamento de Cardiología, Sociedad interamericana de Cardiología, Ciudad de México, México; 5Departamento de Cardiología, Instituto Nacional de Cardiología Ignacio Chávez, Ciudad de México, México; 6Departamento de Cardiología, Consejo Interamericano de Electrocardiográfica y Arritmias, Ciudad de México, México; 7Departamento de Cardiología, Universidade Estadual de Campinas, Campinas, Brasil; 88Departamento de Cardiología, Sociedad Latinoamericana del Ritmo Cardiaco, Montevideo, Uruguay; 9Departamento de Cardiología, Hospital Ángeles Pedregal, Ciudad de México, México; 10Departamento de Cardiología, Instituto de Cardiología y Cirugía Cardiovascular, La Habana, Cuba; 11Unidad
de Electrofisiología, Arritmias y Marcapasos, CEDIMAT, Santo Domingo, República Dominicana;12Departamento de Cardiología, Hospital Luis Vernaza, Guayaquil, Ecuador; 13Centro de Investigaciones Clínicas, Fundación Valle del Lili, Cali, Colombia; 14Departamento de Cardiología, Comisión Honoraria para la Salud Cardiovascular, Montevideo, Uruguay; 15Departamento de Cardiología, Hospital Clínica Bíblica, San José, Costa Rica
ARTÍCULO ESPECIAL
Resumen
Los estudios epidemiológicos sugieren que aproximadamente la mitad de los pacientes con insuficiencia cardiaca (IC) tiene fracción de eyección reducida, mientras que la otra mitad, fracción de eyección (FE) normal. Actualmente, las guías interna-
cionales consideran la duración de QRS mayor a 130 ms, en presencia de disfunción ventricular (FE < 35%), como criterio para selección de pacientes a terapia de resincronización cardiaca (TRC). La TRC ayuda a restaurar la sincronía intraven- tricular y auriculoventricular, mejorando el rendimiento del ventrículo izquierdo (VI), reduciendo la regurgitación mitral funcional e induciendo la remodelación inversa del VI. Esto se evidencia en el aumento del tiempo de llenado del VI y la fracción de eyección del VI, la disminución de los volúmenes telediastólico y telesistólico del VI, y la regurgitación mitral y discinesia septal. Como los mecanismos de la disincronía pueden ser heterogéneos, es posible que ninguna medida prediga con exac-
titud la respuesta a la TRC. Finalmente, la TRC cardiaca ha demostrado progresivamente ser segura y factible, mejora el estado funcional y la calidad de vida, remodela inversamente el VI, disminuye el número de hospitalizaciones, la mortalidad total en pacientes con IC refractaria, la disfunción ventricular izquierda y los trastornos de conducción intraventricular; es una terapia basada en marcapasos para la IC y gracias a la tecnología actual es posible realizar una supervisión remota y segura de casi todos los tipos de dispositivos cardiacos y obtener alertas útiles en la práctica clínica.
Palabras clave: Terapia de resincronización cardiaca. Insuficiencia cardiaca. Fracción de eyección ventricular.
Abstract
Epidemiological studies suggest that approximately half of the patients with heart failure (HF) have reduced ejection fraction,
while the other half have normal ejection fraction (EF). Currently, international guidelines consider QRS duration greater than 130 ms, in the presence of ventricular dysfunction (EF < 35%), as a criterion for selecting patients for cardiac resynchroni-
zation therapy (CRT). CRT helps restore intraventricular and auriculoventricular synchrony, improving left ventricular (LV) performance, reducing functional mitral regurgitation, and inducing reverse LV remodeling. This is evidenced by increased
LV filling time and left ventricular ejection fraction, decreased LV end-diastolic and end-systolic volumes, mitral regurgitation,
and septal dyskinesia. Because the mechanisms of dyssynchrony may be heterogeneous, no single measure may accurately
predict response to CRT. Finally, CRT has been progressively shown to be safe and feasible, improves functional status and
quality of life, reversely remodels the LV, decreases the number of hospitalizations, total mortality in patients with refractory
HF, LV dysfunction, and intraventricular conduction disorders; is a pacemaker-based therapy for HF and thanks to current
technology, safe remote monitoring of almost all types of cardiac devices is possible and provides useful alerts in clinica practice.
Keywords: Cardiac resynchronization therapy, Heart failure, Ventricular ejection fraction.
Introducción
La insuficiencia cardiaca (IC) corresponde a un defecto de la función cardiaca (de vaciado o de llenado) que conduce a un aumento de las presiones auriculares y síntomas como disnea y edema. Se ha reportado en el Reino Unido que la mortalidad de pacientes hospitalizados por IC alcanza el 9.6%1. A lo largo del tiempo se ha estudiado ampliamente el riesgo de mortalidad asociado a las anomalías del electrocardiograma2. Adicionalmente se ha reportado la variación del pronóstico con la duración del QRS en pacientes con IC y disfunción ventricular izquierda3; por otra parte, se ha resaltado que la duración prolongada del QRS (> 120 ms) como marcador de disincronía ventricular es un predictor independiente de mortalidad en la IC sistólica4.
A nivel internacional se publican con regularidad estudios poblacionales que buscan optimizar el diagnóstico y tratamiento de pacientes con IC, uno de los cuales, con gran impacto a nivel mundial, es el Registro Sueco de Insuficiencia Cardiaca (S-HFR)5. Otros estudios se han dedicado a reportar la fisiología de la sincronía, con la orientación de la fibra ventricular durante la diástole y la sístole6, así como también los mecanismos fisiopatológicos subyacentes la disincronía ventricular. Múltiples investigaciones recientes han demostrado que es posible revertir cambios biomoleculares haciendo uso de la terapia de resincronización cardiaca (TRC). Teniendo en cuenta lo expuesto anteriormente, el objetivo de esta revisión multidisciplinaria fue profundizar en el conocimiento sobre el uso apropiado de la TRC en la IC.
Epidemiología de la insuficiencia cardiaca según fracción de eyección del ventrículoizquierdo y QRS
La IC afecta del 1-2% de la población adulta en el mundo occidental, dicha prevalencia se incrementa con la edad, alcanzando hasta el 7-8% en personas mayores de 75 años. Los estudios epidemiológicos sugieren que aproximadamente la mitad de los pacientes con IC tiene fracción de eyección (FE) reducida, mientras que la otra mitad, FE normal o preservada, siendo esta última la forma dominante de IC en adultos mayores, sobre todo en mujeres. En el Reino Unido, más del 70% de los pacientes ingresados con IC aguda tenían FE reducida1. En la población general, la prolongación del QRS y/o el bloqueo de rama izquierda del haz de His (BRIHH) está presente el 1% en los adultos y aumenta entre un 5% a17% a los 80 años, esto asociado a un pronóstico adverso2. En IC con FE reducida la prolongación del QRS y/o BRIHH está presente en el 24-47%, lo cual
se asocia con un mayor incremento de la mortalidad. En la IC con FE preservada, el BRIHH está presente entre un 8-40%3,4. En el S-HFR, la prolongación del QRS mayor de 120 ms estuvo presente en el 31% de los pacientes, siendo más frecuente en aquellos con FE reducida. Una vez presente, fue un marcador de riesgo de mortalidad, independientemente de la FE5.
Fisiología de la asincronía y fisiopatología de la disincronía
Fisiología de la sincronía
El corazón estructuralmente normal muestra cierto grado de falta de uniformidad en la contracción debido a su compleja arquitectura espacial y geométrica, donde la orientación de la fibra ventricular se rige prin- cipalmente por su ubicación transmural dentro de la pared del miocardio. Las fibras dentro de las regiones epicárdicas y endocárdicas están orientadas a lo largo del eje longitudinal del corazón, mientras que las fibras dentro de la región de la pared media están orientadas circunferencialmente. Esto permite un movimiento contráctil complejo con activación sistólica que implica un movimiento circunferencial y acortamiento longitudinal desde el ápex hasta la base6. Dada la arquitectura heterogénea y compleja de la
fibra miocárdica, es necesario que las regiones del corazón se activen eléctricamente de forma temporal, para una función de bombeo más eficiente. Específicamente, la activación eléctrica a través del sistema His-Purkinje produce un frente de onda eléctrico ven- tricular que inicia en el endocardio y el ápex y termina en el epicardio y la base, resultando en disparidades
regionales de la activación eléctrica entre 80-100 ms de inicio a fin. Es esta asociación entre la activación eléctrica y la arquitectura de las fibras miocárdicas lo que permite una eficiente función de bombeo7 El acortamiento inicial del subendocardio provoca una breve rotación en sentido horario del vértice del ventrículo izquierdo (VI) durante la contracción isovolumétrica. La propagación transmural posterior de la activación eléctrica produce un acortamiento simultáneo de las fibras subendocárdicas y subepicardiales. La deformación por torsión de la pared del VI causa un reordenamiento de la fibra que maximiza el engrosamiento de la pared del VI. En particular, la torsión y el cizallamiento de las fibras subendocárdicas también deforman la matriz y dan como resultado el almacenamiento de energía potencial mediante la compresión de proteínas cardiacas como la titina. La energía potencial almacenada en la titina se libera posteriormente durante la diástole, lo que ayuda a la relajación del miocardio y al llenado diastólico. La secuencia de rotación horaria del vértice del VI coincide con el inicio de la relajación isovolumétrica. Alrededor del 50% de la torsión se completa durante el tiempo de relajación isovolumétrica sin ningún cambio en el volumen del VI. Finalmente, una gran parte de la rotación restante se completa durante la diástole temprana con contribuciones mínimas durante la diástasis y la diástole tardía8. Se ha demostrado que las alteraciones en la pre-
carga, la poscarga y la contractilidad alteran la rotación cardiaca. La relación directamente proporcional entre la torsión y el volumen diastólico final del VI y la relación inversamente proporcional entre la torsión y el volumen sistólico final ilustran la dependencia del volumen de la torsión del VI. El VI funciona mejor cuando la dispersión regional de contracción y relajación es
sincrónica, particularmente en ausencia de anomalías en la conducción.
Fisiopatología de la disincronía
La disincronía en la contracción miocárdica ha sido reconocida como un hallazgo frecuente en pacientes con IC avanzada. Debido a la relación entre la activación eléctrica y la función mecánica, no es sorprendente que la disincronía mecánica intraventricular sea resultado de un patrón de activación eléctrica anormal, o disincronía eléctrica. En pacientes con IC con defectos de la conducción tipo BRIHH o conducción intramiocárdica lenta es frecuente esta disincronía y dan como resultado un retraso regional de la activación eléctrica a nivel de la fibra miocárdica, lo que se traduce en una deficiencia del rendimiento de la función de bombeo del corazón. Puede existir disincronía del VI en ausencia de activación eléctrica anormal o retrasada. Pacientes con IC sistólica y complejo QRS estrecho pueden presentar disincronía mecánica entre un 30-50% de los casos,
mientras que pacientes con IC sin disfunción sistólica tienen evidencia de disincronía. Esto explica porque no toda la disincronía es igual y que la esta puede obedecer a uno o ambos mecanismos9,10.
La disincronía en la IC, sobre todo en pacientes con QRS ancho y patrón de BRIHH, se manifiesta por demoras en el tránsito del frente eléctrico de activación ventricular, y, por tanto, se presenta una contracción retrasada a nivel de los segmentos laterales del VI. De este modo, la sístole de la pared retrasada se genera cuando los segmentos del septum interventricular y cara anterior ya están en franca relajación, dando como consecuencia un bombeo inefectivo11.
Como los vectores de fuerza laterales emergen tardíamente y con una dirección y sentido opuesto a los del resto del ventrículo, al apreciar el comportamiento mecánico ventricular con técnicas modernas de imagen aparecen signos clásicos, como el «traqueteo apical» (rocking apex). La pérdida de eficiencia causa que el volumen sistólico caiga, al igual que el gasto cardiaco, este último cuando los mecanismos compensatorios empiezan a agotarse y van agravándose otros problemas colaterales, como la aparición y progresión de insuficiencia valvular mitral funcional12. La disincronía mecánica del VI puede resultar de una variedad de perturbaciones, que incluyen anomalías de la conducción eléctrica, disfunción sistólica del VI, cicatriz e isquemia. Puede manifestarse como disincronía auriculoventricular, interventricular e intraventricular, que puede afectar la sístole, la diástole o ambas13.
Diagnóstico de disincronía ventricular
El BRIHH se encuentra en aproximadamente un tercio de los pacientes con IC y se considera un marcador de disincronía, ya que determina un retraso en la activación eléctrica y mecánica del ventrículo, mientras que la duración de QRS mayor a 120 ms se ha identificado como un predictor de efectos adversos en morbilidad y muerte súbita14-16. Sin embargo, en el acoplamiento entre la activación eléctrica y la contracción mecánica interactúan mecanismos complejos que hacen de la disincronía ventricular una variable continua con diferentes grados de severidad, tal como ocurre en la cardiopatía isquémica, en donde existen varios segmentos con trastornos de movilidad y por tanto mayor prevalencia de disincronía17.
Existe también un número considerable de pacientes que electrocardiográficamente tienen QRS normal o ligeramente prolongado que manifiestan disincronía ventricular18. La disincronía mecánica se determina en función del retraso de activación mecánica en su componente intraventricular e interventricular. Los métodos ecocardiográficos tradicionales para evaluar la disincronía mecánica son modo M, 2D, eco tridimensional y Doppler tisular, así como nuevas técnicas analíticas como strain rate, sincronización tisular y speckle tracking. De manera general, dichas técnicas evalúan intervalos de tiempos de activación, velocidades sistólicas en distintos segmentos de la pared ventricular, desplazamiento de tejido y deformidad de las fibras19.
La disincronía interventricular se define como el desacoplamiento en la activación del VI con respecto al derecho. Un retraso mecánico interventricular, es decir, la diferencia de tiempo entre el intervalo preexpulsivo aórtico y pulmonar mayor a 40 ms es indicativo de disincronía interventricular. Esta disincronía se refiere a la activación tardía de un segmento determinado del VI en relación con su pared opuesta: basal septal, lateral, anterior, inferior y posterior. Un retraso en el periodo preexpulsivo izquierdo (intervalo desde el inicio de QRS al inicio de flujo aórtico por Doppler) mayor a 140 ms sugiere disincronía intraventricular. El intervalo en tiempo del desplazamiento sistólico máximo del septum interventricular y la pared posterior > 130 ms es también indicativo de disincronía intraventricular y es también predictor de respuesta a la TRC20,21. Los diferentes métodos para medición de disincronía y sus valores correspondientes se describen en la tabla 1. Actualmente, las guías internacionales consideran la duración de QRS mayor a 130 ms, en presencia de disfunción ventricular (FE < 35%) como criterio para selección de pacientes a TRC22. En la encuesta EuroHeartFailure, el 41% de los pacientes con FE < 35% tuvieron duración de QRS > 120 ms, el 7% bloqueo de rama derecha, el 34% BRIHH y otros trastornos de la conducción interventricular y el 17% QRS > 150 ms23. La evidencia de disincronía mecánica en pacientes con QRS prolongado identifica a un grupo de respondedores de acuerdo con parámetros clínicos y ecocardiográficos; sin embargo es importante considerar que la prevalencia de disincronía mecánica dependerá del método de imagen utilizado, las condiciones de sobrecarga hemodinámica y los trastornos de la función ventricular24.
– El ensayo clínico Predictors of Response to CRT
(PROSPECT) evaluó la utilidad clínica de varios índices de disincronía mecánica en pacientes con FE
< 35% y duración de QRS > 130 ms; sin embargo
los resultados evidenciaron gran variabilidad dependiente del operador en la medición de disincronía con un pobre valor predictivo25.
– El ensayo clínico Cardiac Resynchronization-Heart Failure (CARE-HF) incluyó pacientes con QRS > 120 ms además de criterios ecocardiográficos de disincronía intraventricular e interventricular. El subanálisis de datos evidenció que un retraso mecánico interventricular (diferencia en tiempo entre flujo aórtico y pulmonar con Doppler pulsado) mayor de 40 ms fue predictor de respuesta a TRC. También se demostró disminución significativa en mortalidad y hospitalización en pacientes clase funcional (CF) de

la New York Heart Association (NYHA) III-IV con
QRS > 150 ms26. En el caso de pacientes en CF
NYHA I-II, la evidencia demuestra disminución de
mortalidad y hospitalización en pacientes con QRS
prolongado y morfología de BRIHH.
– El análisis de subgrupos preespecificados en los
ensayos clínicos Multicenter Automatic Defibrillator
Implantation Trial with Cardiac Resynchronization
Therapy (MADIT-CRT), Resynchronization–Defibri-
llation for Ambulatory Heart Failure Trial (RAFT), y
Resynchronization Reverses Remodeling In Systolic
Left Ventricular Dysfunction demostraron el mayor
beneficio terapéutico en pacientes con QRS > 150
ms; mientras que el impacto en pacientes con QRS
de morfología distinta a BRIHH no fue significati-
vo27-29. Finalmente, no existe beneficio de TRC en
pacientes con QRS < 120 ms, incluso con evidencia
ecocardiográfica de disincronía, tal como se demos-
tró en el estudio RethinQ (Cardiac Resynchroniza-
tion Therapy in Patients with Heart Failure and
Narrow QRS)30.
Con base en lo anterior, la selección de pacientes
candidatos a TRC no debe realizarse exclusivamente
por criterios de disincronía mecánica, ya que las técni-
cas de imagen son múltiples y los resultados diversos;
sin embargo los parámetros basales de disincronía
mecánica son útiles para evaluar la respuesta aguda
de la terapia y pueden ser predictores independientes
de respuesta favorable a TRC. La determinación de
disincronía por parámetros ecocardiográficos también
es útil para la optimización de la estimulación BiV, así
como para la selección del sitio de mayor retraso al
momento del implante31. La morfología de BRIHH en
pacientes con IC y FEVI severamente disminuida iden-
tifica a los pacientes con indicación de TRC, teniendo
claro que aquellos con QRS > 150 ms tienen mayor
beneficio32.
Terapia de resincronización cardiaca:
estudios clínicos
La progresión de IC es el mecanismo de muerte más
común entre los pacientes con IC avanzada. La TRC
ha demostrado ser segura, mejora el estado funcional
y la calidad de vida, remodela inversamente el VI, dis-
minuye el número de hospitalizaciones, la mortalidad
total en pacientes con IC refractaria, la disfunción ven-
tricular izquierda y los trastornos de conducción intra-
ventricular; es una terapia basada en marcapasos para
la IC33.
– El ensayo clínico Comparison of Medical Therapy,
Pacing, and Defibrillation in Heart Failure (COMPA-
NION) evaluó el efecto de la TRC34. Incluyó pacien-
tes en CF III-IV, con FEVI ≤ 35%, en ritmo sinusal,
con un PR ≥ 150 ms y un QRS ≥ 120 ms. El bene-
ficio se concentró en los pacientes que tenían QRS
más ancho, esto es, un QRS > 168 m; en los pacien-
tes con QRS entre 148 y 168 ms hubo tendencia del
beneficio, en los pacientes que tenían un QRS ≤ 147
ms prácticamente no hubo diferencia entre el trata-
miento médico y el tratamiento de intervención
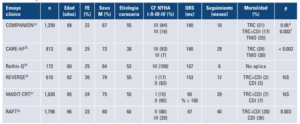
– El estudio CARE-HF35 incluyó pacientes en CF III-IV,
con FEVI ≤3 5%, en ritmo sinusal, con un diámetro
de fin de diástole > 30 mm. Los pacientes ingresaban
con un QRS ≥ 120 ms, y además dos de tres crite-
rios de disincronía mecánica: un periodo preeyectivo
aórtico mayor que 140 ms, o un retraso interventri-
cular superior a 40 ms, o un retraso de la pared
posterolateral del VI. El estudio CARE-HF incorporó
la evidencia de disincronía mecánica en los pacien-
tes con QRS poco ancho. El punto final primario de
muerte u hospitalización por causa cardiovascular
fue alcanzado por el 55% de los pacientes en trata-
miento médico y el 39% de los pacientes con TRC.
La muerte como punto final ocurrió en el 30 y 20%,
respectivamente; la TRC generó una reducción de la
mortalidad del 36% (en ambas ramas, un tercio de
las muertes fueron súbitas). Se observó más benefi-
cio en los pacientes con QRS ≥ 160 ms, sin diferen-
cia entre coronarios e idiopáticos. El estudio
CARE-HF tiene el mérito de haber demostrado que
la TRC sin cardiodesfibriladores implantables (CDI)
reduce la mortalidad total (Tabla 2).
– Estudio RethinQ30: intentó demostrar que la presen-
cia de un QRS < 130 ms y la presencia de asincronía
mecánica (no todos los pacientes con QRS ancho
tienen disincronía mecánica, ya que puede verse en
pacientes con QRS angosto), mejoran el punto final
primario, que es el porcentaje de pacientes que me-
joraran 1 ml/kg/minuto el consumo de oxígeno máxi-
mo. Como objetivo secundario se consideró mejoría
en la calidad de vida y la caminata de seis minutos.
A los seis meses no hubo diferencia significativa en
el punto final primario ni en los puntos secundarios.
Lo único que se evidenció en los pacientes con TRC
fue leve mejoría en la capacidad funcional. En un
análisis post hoc que comparó el 26% de los pacien-
tes con un QRS entre 120 y 130 ms vs. QRS angosto
se vio que en los primeros había una mejoría en el
consumo de oxígeno. Esto indica que cuanto más
ancho es el QRS, mayor es la probabilidad de tener
alguna mejoría con la TRC (Tabla 2).
– Estudio REVERSE36: el objetivo del estudio fue si la
TRC tenía igual beneficio en CF NYHA I-II. El punto
final primario era un score clínico que definía si el
paciente había empeorado, seguía igual o había me-
jorado (empeoramiento: muerte, hospitalización o
progresión de la enfermedad); el punto final secun-
dario fue la variación en el índice del volumen de fin
de sístole del VI a 12 meses. Durante el seguimiento,
empeoró el 16% de los pacientes que tenían TRC,
frente al 21% de aquellos en los que no estaba fun-
cionando. Esta diferencia no fue estadísticamente
significativa y el estudio REVERSE tuvo resultado
negativo (Tabla 2).
– Estudio MADIT-CRT37: demostró la seguridad y efi-
cacia en la colocación y utilización de forma tempra-
na de TRC y CDI (TRC-D) en pacientes con IC
asintomáticos o levemente sintomáticos, con FEVI
reducida y complejo QRS > 130 ms. Reducción del
34% del riesgo relativo de eventos no fatales, de IC
o muerte por alguna causa, en comparación con
aquellos a los que se les implantó solo un CDI. Este
estudio concluye que la TRC-D reduce la mortalidad
en pacientes asintomáticos o con síntomas leves de
IC (NYHA I-II), con disfunción del VI y BRIHH
(Tabla 2).
– Estudio RAFT38: este estudio evaluó el impacto de
la TRC en hospitalizaciones en pacientes asignados
al azar a CDI o TRC-D. La TRC-D reduce significa-
tivamente las hospitalizaciones y días de hospitaliza-
ción en pacientes con IC NYHA clase II-III en
comparación con la terapia CDI a pesar del aumento
de los ingresos por indicaciones relacionadas con el
dispositivo (Tabla 2).
Indicaciones y contraindicaciones de la
terapia de resincronización cardiaca
El pronóstico de la IC es generalmente pobre. De los
pacientes ingresados en un hospital por IC y FEVI
reducida, a pesar del tratamiento médico óptimo (TMO),
la mortalidad anual es de alrededor del 20% en pacien-
tes menores de 75 años y del 40% si son mayores de
75 años. El tratamiento de la IC parece mejorar signi-
ficativamente el pronóstico, incluso la mortalidad,
según los criterios de las guías actuales, y solo una
pequeña parte de pacientes con IC requieren TRC,
esto es, alrededor del 5 al 10%.
La TRC ayuda a restaurar la sincronía intraventricular
y auriculoventricular, mejorando el rendimiento del VI,
reduciendo la regurgitación mitral funcional e indu-
ciendo la remodelación inversa del VI. Esto se eviden-
cia en el aumento del tiempo de llenado del VI y la
FEVI, la disminución de los volúmenes telediastólico y
telesistólico del VI, y la regurgitación mitral y discinesia
septal. Como los mecanismos de la disincronía pueden
ser heterogéneos, es posible que ninguna medida pre-
diga con exactitud la respuesta a la TRC. Está demos-
trado por diversas técnicas de imagen que el beneficio
hemodinámico agudo está asociado tanto con la mag-
nitud de la asincronía mecánica previa al implante,
como con el grado de resincronización mecánica
durante CRT39.
Si un paciente presenta síntomas y signos de IC con
FEVI reducida, antes de proceder a la TRC, algunos
aspectos que se deben evaluar son la CF, el trata-
miento farmacológico, el ritmo auricular o el tipo de
bloqueo de rama y el ancho del QRS.
– CF: los pacientes en CF NYHA III-IV presentan evi-
dencia de los beneficios de la TRC tanto a corto
como a largo plazo en términos de CF, caminata de
seis minutos, calidad de vida, marcadores sanguí-
neos, remodelado inverso y mortalidad. Los pacien-
tes con mayor beneficio son aquellos en clase
«ambulatoria» III y IV, mientras que los pacientes en
clase IV hospitalizados son menos representativos
en los ensayos aleatorizados.
– Los pacientes de clase IV tratados con TRC tuvieron
una disminución significativa en los criterios de valo-
ración combinados (hospitalización y mortalidad),
pero solo una tendencia en las muertes por IC40.
Cuatro estudios incluyeron pacientes en clase I-II y
mostraron mejoras en la función del VI, hospitaliza-
ción por IC y mortalidad total38. Los estudios que
incluyeron pacientes en clase I (REVERSE36, MA-
DIT-CRT41) no mostraron una disminución significati-
va en la mortalidad o la hospitalización por IC. Por
lo tanto, las recomendaciones para TRC son pacien-
tes en CF NYHA II, III o IV (ambulatorios).
– Bloqueo de rama izquierda del haz de His: el BRIHH
es un requisito para decidir implantar un dispositivo
de TRC. Los pacientes con un complejo QRS ancho
tienen un peor pronóstico y responden mejor a la
TRC. En el estudio MADIT-CRT41, los pacientes con
BRIHH respondieron mejor que aquellos con altera-
ciones inespecíficas de la conducción intraventricular
(IVCD). La mejoría en el compuesto primario de even-
to de IC y muerte fueron significativamente menores
en los pacientes sin BRIHH. Las tasas de mortalidad
a los tres años observadas fueron significativamente
menores en pacientes con BRIHH (7% BRIHH, 12%
BRDHH y 15% IVCD, respectivamente)27.
– Duración del intervalo QRS: la duración del intervalo
QRS fue ≥ 120 ms como criterio de inclusión utili-
zado en la mayoría de los ensayos clínicos aleatori-
zados. El análisis de subgrupos en un metaanálisis
que evaluó el impacto de la duración del QRS en la
eficacia de la TRC mostró que en los pacientes con
IC en CF NYHA III-IV, la TRC redujo significativa-
mente la mortalidad por todas las causas o la hospi-
talización en pacientes con duración del QRS ≥
150 ms (COMPANION y CARE-HF)34,35. La magnitud
del efecto y la certeza del beneficio disminuyeron
con una duración más corta de QRS. Además, la
mayoría de los pacientes en los ensayos clínicos
tenían morfología de BRIHH, lo que se asoció con
un beneficio más pronunciado, en comparación con
los pacientes sin BRIHH. El análisis combinado de
los ensayos MADIT-CRT37, REVERSE36 y RAFT38
mostró que los pacientes con una duración QRS ≥
150 ms se beneficiaron más de la CRT42. El análisis
de subgrupos basado en la morfología del QRS en
los ensayos MADIT-CRT37, RAFT38 y REVERSE36 y
un metaanálisis de COMPANION34, CARE-HF35, MA-
DIT-CRT37 y RAFT38 sugiere que los pacientes con
BRIHH completo mostraron un mayor beneficio en el
compuesto de morbilidad/mortalidad por TRC, en
comparación con pacientes sin BRIHH43. Con base
en esta evidencia, las recomendaciones actuales de
clase I se restringieron a pacientes con BRIHH com-
pleto. Strauss et al.44 revisaron el término BRIHH y
propusieron los criterios para diagnosticar un BRIHH
verdadero: la anchura del QRS debe ser ≥ 130 ms
para las mujeres y ≥ 140 ms para los hombres, junto
con muescas o borrosidad en el QRS medio en ≥ 2
derivaciones contiguas.
A continuación se presentan las recomendaciones
para TRC22:
– Pacientes con IC (clase II, III, IV ambulatoria) + FEVI ≤ 35%
+ ritmo sinusal + TMO
• BRIHH + QRS ≥ 150 ms: IA (clase y LOE)
• BRIHH + QRS 130-149 ms: IB
• Sin BRIHH + QRS ≥ 150 ms: IIa B
• Sin BRIHH + QRS 130-149 ms: IIb B
– Marcapasos de novo (bloqueo auriculoventricular
[AV] o fibrilación auricular [FA] lenta + disfunción
VI: IA.
– Pacientes con IC (clase II, III, IV ambulatoria) + FEVI
≤ 35% + FA + TMO + SR esperada + QRS ≥ 130
ms: IIa.
– IC desarrollada después del implante de un marcapasos/
CDI + disfunción del VI + % de estimulación del ventrícu-
lo derecho (VD) alto + TMO: IIb B.
– QRS < 130 ms: III (contraindicado).
Terapia de resincronización cardiaca en
poblaciones especiales
La TRC ha demostrado mejorar la sobrevida y dis-
minuir el riesgo de hospitalizaciones en pacientes con
IC y FE disminuida, no obstante, merecen mención
particular los resultados en poblaciones especiales.
Mujeres
La evidencia muestra que el sexo femenino es un
predictor independiente de respuesta favorable a la
TRC, sin embargo existe una tendencia global a la
subutilización de dispositivos de alta energía en muje-
res por factores no bien definidos45. Los metaanálisis
sobre el impacto de la terapia por diferencia de sexo
demuestran de manera consistente una disminución de
mortalidad por cualquier causa en mujeres. El subaná-
lisis relacionado con sexo en MADIT-CRT mostró un
menor riesgo de muerte por arritmias (taquicardia ven-
tricular/fibrilación ventricular) en mujeres con cardiopa-
tía isquémica; no obstante, quienes reciben una terapia
apropiada del CDI, tienen significativamente mayor
mortalidad poschoque en comparación con su contra-
parte masculina.
Por otro lado, se observó una disminución del 70%
en eventos relacionados con IC y reducción de riesgo
de muerte del 72% en mujeres46,47. En el estudio
REVERSE36 los resultados más relevantes fueron el
remodelado inverso y el mayor tiempo a la primera
hospitalización por IC en pacientes con TRC; el efecto
en remodelado inverso es significativamente mejor en
mujeres en comparación con hombres48,49. A pesar de
ello, la evidencia muestra una clara subutilización de
la terapia.
En los ensayos clínicos europeos, únicamente el 24% de
los pacientes que recibieron TRC fueron mujeres, mientras
que en estudios norteamericanos la proporción de
mujeres corresponde al 22-26%, a pesar de que el
beneficio de la terapia es independiente al sexo50,51. El
registro Improve the Use for Evidence-Based Heart
Failure Therapies (IMPROVE-HF), demostró que el uso
de TRC y/o CDI mejora significativamente la sobrevida
en mujeres, específicamente en términos de rehospi-
talización y remodelado ventricular52. Los factores clí-
nicos relacionados con dicho fenómeno son la
presencia de BRIHH, IC de origen no isquémico y
mayor uso de betabloqueadores. Por otro lado, en
hombres es más frecuente la coexistencia de enferme-
dad renal crónica, FA y morfología de QRS distinta a
rama izquierda, siendo todos ellos factores relaciona-
dos con mala respuesta a la terapia.
Ancianos
La TRC ha demostrado beneficios clínicos en la
población mayor de 75 años a pesar de las múltiples
comorbilidades como diabetes, hipertensión y FA. La
mejoría en síntomas, duración de QRS y FEVI es simi-
lar a la observada en pacientes jóvenes53. El riesgo de
complicaciones es similar tanto en octogenarios como
en cohortes de menor edad, la mejoría clínica y sinto-
mática es significativa en pacientes de mayor edad10,54.
El análisis de subgrupos de pacientes mayores de 80
años en cinco ensayos clínicos muestra una tendencia
al aumento de neumotórax relacionado con el implante,
por lo que proponen como técnicas para disminución
de riesgo el uso de ultrasonido para acceso vascular,
punción de vena cefálica o axilar como sitio alterno a
la vena subclavia55.
El análisis post hoc del estudio CARE-HF (TRC vs.
TMO en CF NYHA III-IV, QRS ancho) describe el efecto
de la TRC en la subpoblación de pacientes mayores
de 70 años; al final del seguimiento el índice de mor-
talidad fue del 30.6% en el grupo TRC vs. 48.3% con
TMO (p = 0.002), lo que demuestra beneficios consis-
tentes con los observados en la población de pacientes
más jóvenes en cuanto a mortalidad por cualquier
causa56.
Es importante considerar que la fragilidad del
paciente geriátrico tiene un impacto directo en la sobre-
vida y rehospitalización por IC, y es también un factor
independiente de no respuesta a la TRC. Las escalas
de fragilidad que evalúan condiciones asociadas como
debilidad muscular, actividad física, pérdida de peso y
deterioro cognitivo son útiles para identificar a los
pacientes que requieren optimización de sus condicio-
nes generales previas al implante y aquellos en quie-
nes la TRC pudiera ser inapropiada57,58.
Clase funcional NYHA I
El uso de TRC en pacientes con IC menos severa
ha sido controvertido, la mejoría en calidad de vida ha
sido moderada y no se ha demostrado disminución en
la mortalidad por cualquier causa o por IC en
pacientes CF NYHA I. Los ensayos clínicos aleatoriza-
dos REVERSE36, MADIT-CRT37 y RAFT38 incluyeron
cerca de 5,000 pacientes con IC ligeramente sintomá-
tica (NYHA I-II) para valorar efecto de la TRC en remo-
delado reverso y morbimortalidad. En el análisis del
subgrupo en MADIT-CRT37 se observó el mayor bene-
ficio clínico en pacientes CF NYHA II con duración de
QRS mayor a 150 ms y morfología de BRIHH, mientras
que en pacientes de las mismas características en CF
NYHA I (18% de la población) no se encontró diferencia
significativa. Por otra parte, el estudio REVERSE36
demostró de manera contundente el efecto de remo-
delado reverso, definido como disminución en volumen
telesistólico, telediastólico e incremento en FEVI, en
pacientes CF NYHA I-II con FEVI < 40%. El remode-
lado inverso se relacionó con un tiempo prolongado de
la primera hospitalización por IC. Cabe mencionar que
el 15% de los pacientes incluidos en el estudio se
encontraron en CF NYHA I48.
Finalmente, los metaanálisis de COMPANION34,
CARE-HF35, MADIT-CRT37 y RAFT38 demuestran el
mayor beneficio de CRT en el grupo de QRS ancho y
morfología de BRIHH, en cuanto a reducción de riesgo
de muerte y hospitalización por IC. La evidencia para
recomendación de TRC en pacientes en CF NYHA I
aún no es concluyente, por lo que la indicación se
extiende únicamente a pacientes sintomáticos59.
Fibrilación auricular
La coexistencia de FA e IC incrementa la mortalidad
y es causa frecuente de exacerbación de los sínto-
mas60,61. Algunos estudios observacionales sugieren
que la FA persistente o permanente limita los benefi-
cios clínicos de la TRC debido a la ausencia de sin-
cronía atrioventricular y a la supresión de la
resincronización cardiaca por FA con respuesta ven-
tricular rápida. El estudio RAFT incluyó 229 pacientes
con FA permanente con criterios para TRC, sin
embargo no se demostró reducción de riesgo en des-
enlace primario (muerte y rehospitalización por IC) en
este subgrupo62.
El estudio Multisite Simulation in Cardiomyopathy
(MUSTIC), ensayo clínico prospectivo y aleatorizado en
pacientes con FA e IC severa, demostró que en pacien-
tes con estimulación BiV > 85% del tiempo hubo mejo-
ría significativa en CF a un año de seguimiento, por lo
que el control de la respuesta ventricular es fundamen-
tal para asegurar la TRC63. La ablación del nodo AV
tiene como objetivo el control definitivo de la frecuencia
ventricular y puede considerarse en pacientes sintomá-
ticos con frecuencia cardiaca > 110 lpm a pesar de
TMO; sin embargo, esta estrategia requiere estimula-
ción permanente22.
Varios estudios han demostrado la superioridad de
TRC en comparación con estimulación permanente del
VD postablación del nodo AV en pacientes con IC
moderada a severa y duración de QRS > 120 ms64,65.
La ablación del nodo AV tiene como objetivo asegurar
la estimulación BiV > 99% y mantener el efecto bené-
fico de la resincronización cardiaca. Algunos metaaná-
lisis comparan los beneficios de TRC en pacientes en
ritmo sinusal con aquellos en FA. De manera general,
los pacientes con FA tienen cambio en la FEVI similar
a los de ritmo sinusal, no obstante, la mejoría en CF,
caminata de seis minutos y calidad de vida es menor;
la mortalidad por cualquier causa y el riesgo de no
respuesta a TRC es mayor61.
Población pediátrica
La TRC en la población pediátrica implica todo un
reto, ya que los criterios comunes para TRC (BRIHH,
duración QRS > 120 ms y FEVI disminuida) son poco
frecuentes, mientras que predominan las cardiopatías
congénitas con anatomías complejas, cambios hemo-
dinámicos y extensas zonas de fibrosis. La evidencia
sobre el beneficio de la TRC en niños y adolescentes
se limita a experiencia de centros, reporte de casos,
sin grandes ensayos clínicos aleatorizados, por lo que
no existen consensos o guías para el uso de TRC en
niños66.
La indicación más frecuente para TRC en el grupo
pediátrico es la disincronía secundaria a estimulación
permanente (42-77%); sin embargo, otras entidades
descritas son la disfunción ventricular izquierda por
miocardiopatía dilatada primaria; disfunción de VD sis-
témico asociada a cardiopatías congénitas (12-33%)
tales como trasposición corregida de grandes arterias
y procedimiento quirúrgico de Mustard o Senning.
Finalmente, se encuentran los pacientes con ventrículo
único disfuncional que son tratados quirúrgicamente
con procedimiento de Fontan o derivación cavo-pulmo-
nar total67,68.
Aunque la tasa de complicaciones al momento del
implante es similar a la de la población adulta (10-29%),
es frecuente la falla o desplazamiento del electrodo
(8-12% de los casos) debido principalmente a la com-
plejidad anatómica del caso69. En el paciente pediátrico
es común el abordaje mixto, que incluye implante de
electrodos epicárdicos vía minitoracotomía, con el
implante adicional de sistemas transvenosos, previa
valoración individualizada de las características anató-
micas, diámetro de la vena y superficie corporal.
A diferencia del paciente adulto, en donde la selec-
ción para la terapia es la disincronía eléctrica (QRS >
120 ms con morfología de BRIHH), en la población
pediátrica existe discordancia entre asincronía eléc-
trica y mecánica. Hasta en el 65% de los casos es
posible demostrar disincronía mecánica mediante téc-
nicas ecocardiográficas y otros métodos de imagen a
pesar de tener duración promedio de QRS < 100 ms,
lo que sugiere que esta población puede beneficiarse
de la TRC aun en presencia de QRS estrecho70.
Por otro lado, la CF NYHA III-IV a pesar de TMO no
es un criterio de selección de candidatos a TRC en
paciente pediátrico. La CF avanzada al momento del
implante es un predictor independiente de mal pronós-
tico, mientras que en niños en CF NYHA I-II existe
una respuesta favorable en cuanto a remodelado
ventricular71.
Los resultados del efecto de la TRC en niños son
variables debido a las variantes anatómicas propias de
cada enfermedad. En un estudio multicéntrico que
incluyó 103 niños con cardiopatía congénita, el resultado
de la TRC fue disminución del ancho de QRS, incre-
mento en la FE del ventrículo sistémico y sobrevida del
95% a un seguimiento a casi cinco meses72. La tasa de
respuesta a la terapia varía del 32 al 76% dependiendo
de los puntos primarios establecidos, se ha reportado
mejoría en la FE de ventrículo sistémico hasta en el 76%
de los casos y mejoría en CF NYHA en el 65% de los
pacientes. En el subgrupo de pacientes con VD sisté-
mico, el 75% muestra mejoría en su CF. Finalmente, el
ventrículo único constituye la variante menos frecuente
de las cohortes y existe mejoría de CF en el 30-50% de
los casos66. A pesar de las variantes anatómicas y alte-
raciones hemodinámicas propias de la población pediá-
trica con cardiopatías congénitas, la TRC parece ser un
tratamiento prometedor para la IC, aunque los criterios
de selección para implante deben adecuarse a las dife-
rentes presentaciones anatómicas.
Terapia de resincronización cardiaca:
complicaciones perioperatorias
Usando la definición de complicación perioperatoria
como un evento que ocurre entre el día del procedi-
miento y los 30 días siguientes, que requiere trata-
miento médico, corrección invasiva o el uso de fluidos
intravenosos, se ha estimado que las principales com-
plicaciones relacionadas con la TRC son:
– Fracaso en la implantación exitosa del cable del VI
(4.5-8.5%).
– Desprendimiento del cable del VI, incluida la pérdida
de captura (2.8-6.9%).
– Estimulación extracardiaca (0.8-4%).
– Hematoma de bolsillo (1.3-3.3%).
– Disección del seno coronario (0.5-2.1%).
– Perforación o taponamiento cardiaco (0.3-2.1%).
– Hemotórax/neumotórax (0.4-1.7%).
– Bloqueo cardiaco completo (0.3-1%).
– Exacerbación de la IC (0.4%).
– Muerte (0.1-0.3%).
La tasa de complicaciones ha disminuido del 28% al
inicio de la técnica, al 4% en la práctica reciente, debido
a un mejor conocimiento, experiencia y mejoras tecnoló-
gicas73. Algunas de las complicaciones comunes men-
cionadas anteriormente, como la imposibilidad de
implantar el cable del VI, suelen conducir a otros intentos
para lograr la resincronización. El implante quirúrgico
directo al epicardio o el implante endocárdico por abor-
daje transeptal agrega nuevas posibilidades de compli-
caciones. La estimulación extracardiaca es la captura del
nervio frénico, principalmente con el cable del VI. El
bloqueo AV completo generalmente es causado por un
bloqueo de rama derecha (BRD) mecánico en un
paciente con BRIHH anterior, y la exacerbación de la IC
puede ocurrir debido a la posición supina, dolor, miedo,
sobrecarga de líquidos o un paciente previamente des-
compensado. Otras complicaciones tienen una explica-
ción mecánica. En 2017 se reportaron las complicaciones
de 439,010 pacientes que se sometieron a implantes de
dispositivos de TRC realizados en EE.UU. entre 2003 y
2013. De ellos, el 6.1% tuvo al menos una complicación.
Los predictores de estas complicaciones fueron edad
mayor de 65 años y sexo femenino (odds ratio [OR]:
1.19). Por el contrario, el ingreso electivo para implante
fue un factor protector (OR: 0.61)74.
En resumen, las complicaciones son frecuentes y
existen algunas condiciones predisponentes que debe-
mos tener en cuenta.
Terapia de resincronización cardiaca:
seguimiento
A medida que más y más personas viven más tiempo
con enfermedades cardiacas, los marcapasos perma-
nentes, los CDI y los dispositivos de TRC se implantan
con mayor frecuencia. Es importante realizar visitas de
seguimiento para probar los dispositivos, con el fin de
asegurar el correcto funcionamiento del sistema y obte-
ner mejores resultados clínicos.
El objetivo del seguimiento después del implante es
lograr la máxima mejoría del estado clínico, en una fina
colaboración entre el equipo de electrofisiología y de IC. Se
ha estimado que alrededor del 30% de los pacientes
no responden a la TRC y el 40% no alcanza signos
ecocardiográficos de remodelado inverso75,76.
Los objetivos principales en las visitas de seguimiento
ambulatorio son:
– Evaluación clínica, de laboratorios y titulación
farmacológica.
– Revisión del dispositivo con optimización de sus
parámetros.
– Seguimiento ecocardiográfico.
La evaluación clínica permitirá confirmar o no la res-
puesta a la TRC. El tratamiento farmacológico debe revi-
sarse y titularse hasta las dosis máximas recomendadas.
El ecocardiograma evaluará los cambios en la FEVI, el
tamaño de las cámaras, la remodelación inversa y, en
algunos centros, se puede utilizar para optimizar la
resincronización.
Los pacientes deben ser seguidos al menos cada seis
meses después de una visita inicial (que se debe reali-
zar en los primeros dos meses posteriores al implante):
– Para pacientes estables con marcapasos o CDI, el
seguimiento puede ser presencial o remoto según el
protocolo local, pero al menos un seguimiento por
año debe ser presencial.
– La frecuencia de las visitas de seguimiento puede au-
mentar en determinadas situaciones clínicas (batería
agotada o sospecha de infección del dispositivo).
La interrogación del dispositivo está destinada a compro-
bar la integridad del sistema, el estado de la batería, las
ondas detectadas, el umbral de los cables, las impedancias,
las frecuencias mínima y máxima, los intervalos AV (detec-
tados y estimulados) y los intervalos VV. Como la incompe-
tencia cronotrópica es frecuente, debe abordarse si el
paciente necesita que se active la respuesta de frecuencia.
Debe prestarse especial atención a la presencia de arritmias
cardiacas como FA o latidos ventriculares prematuros fre-
cuentes, ya que pueden disminuir la resincronización y
empeorar la IC.
Además, existen algoritmos que optimizan el dispositivo
automáticamente. La monitorización remota es una opción
valiosa para detectar alertas por pérdida de resincroniza-
ción, arritmias, daño en la integridad del dispositivo o
detección temprana de IC. Debe intentarse buscar el 100%
de estimulación BiV sostenida y eficaz para lograr la res-
puesta a la TRC. Un estudio informó una reducción del 44%
en el criterio de valoración compuesto de mortalidad y
hospitalización por IC en pacientes que recibieron del 93 al
100% de estimulación BiV en comparación con menos
estimulación77.
Durante varias décadas, la evaluación de seguimiento
de los dispositivos cardiacos electrónicos implantables
ha requerido una evaluación en el consultorio para eva-
luaciones periódicas del dispositivo. La tecnología actual
ha evolucionado para permitir la supervisión remota
segura de casi todos los tipos de dispositivos y propor-
ciona alertas útiles en la práctica clínica, incluso si no
son tan completas como una evaluación de los disposi-
tivos en el consultorio. Para la mayoría de los pacientes,
gran parte de las evaluaciones de seguimiento de los
dispositivos implantables se pueden realizar en persona
o de forma remota78,79. Después del control postimplan-
tación inmediato, se debe realizar una primera visita
personal entre semanas y tres meses después de la
implantación, idealmente, una visita personal por año
(otras evaluaciones de seguimiento se pueden reali-
zar en persona o de forma remota en caso de estar

disponibles). En general, una estrategia para monitorear
e interrogar dispositivos de forma remota parece ser tan
segura y efectiva como una estrategia que incluye visi-
tas al consultorio dos veces al año80-82.
En el seguimiento el objetivo es obtener el máximo
aprovechamiento del dispositivo por medio del control
de factores de riesgo, TMO y optimización de la TRC,
la cual debe ser planeada cuidadosamente por el
equipo del corazón (que incluye los especialistas en
cardiología, electrofisiología e IC).
Indicaciones de TRC de las guías clínicas
internacionales
Las recomendaciones de la Sociedad Americana del
Corazón/Colegio Americano de Cardiología (AHA/
ACC)83 se presentan en la tabla 3 y las recomendacio-
nes de la Sociedad Europea de Cardiología (ESC)22 se
presentan en la tabla 4.
Similitudes y diferencias entre las guías
clínicas europeas y norteamericanas de
insuficiencia cardiaca
Similitudes84
– TRC:
• FEVI ≤ 35%, CF II-IV, BRIHH con QRS ≥ 150 ms.
• FEVI ≤ 35%, FA, si el paciente requiere esti-
mulación ventricular o cumple con los criterios
para TRC, o será sometido a ablación del nodo
AV u otra terapia de control de frecuencia que
permita una estimulación ventricular cercana
al 100%.
– CDI:
• FEVI ≤ 35%, CF II-III (NYHA) o CF II con FEVI
≤ 30% en TMO.
• Prevención secundaria.
Diferencias
– TRC:
• FEVI ≤ 35%, QRS ≥ 150 ms, sin patrón de
BRIHH.
• ACC/AHA: clase IIa en CF III, IIb en CF II.
• ESC: clase IIa.
• FEVI ≤ 35%, BRIHH con QRS intermedio.
• ACC/AHA: clase IIb (QRS 120-149 ms).
• ESC: clase I (QRS 130-149 ms).
• FEVI ≤ 35%, QRS intermedio, sin patrón de
BRIHH.
• ACC/AHA: clase III.
• ESC: clase IIb.
• QRS < 130 ms.
• ACC/AHA: no mencionado.
• ESC: clase III.

– CDI:
• Previo al recambio del dispositivo el paciente debe
ser cuidadosamente reevaluado por un cardiólogo
experimentado debido a que la situación clínica y
los objetivos de su manejo pueden haber
variado.
• ACC/AHA: no mencionado.
• ESC: clase IIa.
• Antes de los 40 días de un infarto agudo de
miocardio:
• ACC/AHA: no mencionado.
• ESC: clase III.
Conclusiones
La IC es una enfermedad prevalente en Latinoamé-
rica y en todo el mundo. Un número considerable de
pacientes con IC presentan QRS prolongado. La TMO
o la terapia médica dirigida por pautas es la piedra
angular del tratamiento para disminuir o retrasar la
progresión de la enfermedad. Existe mucha evidencia
clínica que indica que la TRC en aquellos pacientes
que reciben TMO mejora la calidad de vida disminu-
yendo la hospitalización y la mortalidad.
Los beneficios eléctricos de la TRC se pueden obte-
ner por medio de diferentes mecanismos, incluida la
restauración de la asincronía intraventricular y auricu-
loventricular, la mejora del rendimiento del VI, la reduc-
ción de la regurgitación mitral funcional y la inducción
de la remodelación inversa del VI, lo que lleva a un
aumento del tiempo de llenado del VI y de la FEVI,
disminuyendo los volúmenes telediastólico y telesistó-
lico del VI, la insuficiencia mitral y discinesia septal.
La TRC está disponible en todos los países de Latinoa-
mérica, ya sea en el sistema de salud público, privado o
mediante donaciones. Con base en la disponibilidad de
esta terapia y su costo variable según el país, depende
de los médicos indicar esta terapia en el paciente ade-
cuado que recibe el TMO. Este documento contribuirá a
optimizar el uso actual de esta terapia avanzada (TRC)
en todos los países de Latinoamérica, ayudando a los
médicos a identificar las terapias adecuadas y los pacien-
tes adecuados, con el fin de obtener los mejores resulta-
dos evidenciados en los ensayos clínicos.
Conflicto de intereses
Los autores declaran no tener conflicto de
intereses.
Financiamiento
La presente investigación no ha recibido ninguna
beca específica de agencias de los sectores públicos,
comercial o con ánimo de lucro.
Responsabilidades éticas
Protección de personas y animales. Los autores
declaran que para esta investigación no se han
realizado experimentos en seres humanos ni en
animales.
Confidencialidad de los datos. Los autores decla-
ran que en este artículo no aparecen datos de
pacientes.
Derecho a la privacidad y consentimiento infor-
mado. Los autores declaran que en este artículo no
aparecen datos de pacientes.
Bibliografía
1. Donkor A, McDonagh T, Hardman S. National Heart Failure Audit April
2014-March 2015 [Internet]. Londres: Healthcare Quality Improvement
Partnership; 2016 [consultado: 25 April 2017]. Disponible en: https://www.
hqip.org.uk/resource/national-heart-failure-audit-2014-2015/#.ZDad-
G3ZByUk
2. Rautaharju PM, Ge S, Nelson JC, Marino Larsen EK, Psaty BM, Fur-
berg CD, et al. Comparison of mortality risk for electrocardiographic ab-
normalities in men and women with and without coronary heart disease
(from the Cardiovascular Health Study). Am J Cardiol. 2006;97(3):309-15.
3. Fosbøl EL, Seibaek M, Brendorp B, Torp-Pedersen C, Køber L; Danish
Investigations and Arrhythmia on Dofetilide (Diamond) Study Group.
Prognostic importance of change in QRS duration over time associated
with left ventricular dysfunction in patients with congestive heart failure:
the DIAMOND study. J Card Fail. 2008;14(10):850-5.
4. Danciu SC, Gonzalez J, Gandhi N, Sadhu S, Herrera CJ, Kehoe R.
Comparison of six-month outcomes and hospitalization rates in heart
failure patients with and without preserved left ventricular ejection fraction
and with and without intraventricular conduction defect. Am J Cardiol.
2006;97(2):256-9.
5. Jonsson A, Edner M, Alehagen U, Dahlström U. Heart failure registry: a
valuable tool for improving the management of patients with heart failure.
Eur J Heart Fail. 2010;12(1):25-31.
6. Streeter DD Jr, Spotnitz HM, Patel DP, Ross J Jr, Sonnenblick EH. Fiber
orientation in the canine left ventricle during diastole and systole. Circ
Res. 1969;24(3):339-47.
7. Cheng A, Helm RH, Abraham TP. Pathophysiological mechanisms un-
derlying ventricular dyssynchrony. Europace. 2009;11(Suppl 5):v10-v14.
8. Bertini M, Sengupta PP, Nucifora G, Delgado V, Ng AC, Marsan NA,
et al. Role of left ventricular twist mechanics in the assessment of cardiac
dyssynchrony in heart failure. JACC Cardiovasc Imaging. 2009;2(12):1425-35.
9. Haghjoo M, Bagherzadeh A, Fazelifar AF, Haghighi ZO, Esmaielzadeh M,
Alizadeh A, et al. Prevalence of mechanical dyssynchrony in heart failu-
re patients with different QRS durations. Pacing Clin Electrophysiol.
2007;30(5):616-22.
10. Wang J, Kurrelmeyer KM, Torre-Amione G, Nagueh SF. Systolic and
diastolic dyssynchrony in patients with diastolic heart failure and the
effect of medical therapy. J Am Coll Cardiol. 2007;49(1):88-96.
11. Trainini JC, Elencwajg B, López Cabanillas N, Herreros J, Lago NE,
Lowenstein JA, et al. Fundamentos de la nueva mecánica cardiaca: la
bomba de succión. Rev Argent Cardiol. 2016;84:73.
12. Gyalai Z, Jeremiás Z, Baricz E, Rudzik R, Dobreanu D. Echocardiographic
evaluation of mechanical dyssynchrony in heart failure patients with reduced
ejection fraction. Technol Health Care. 2016;24(Suppl 2):S587-92.
13. Soman P, Marwick TH. Left Ventricular Dyssynchrony: Prognostic Marker
or Disease Mechanism? JACC Cardiovasc Imaging. 2019;12(7
Pt 1):1227-9.
14. Kashani A, Barold SS. Significance of QRS complex duration in patients
with heart failure. J Am Coll Cardiol. 2005;46(12):2183-92.
15. Witt CM, Wu G, Yang D, Hodge DO, Roger VL, Cha YM. Outcomes With
Left Bundle Branch Block and Mildly to Moderately Reduced Left Ventri-
cular Function. JACC Heart Fail. 2016;4(11):897-903.
16. Linde C, Ellenbogen K, McAlister FA. Cardiac resynchronization therapy
(CRT): clinical trials, guidelines, and target populations. Heart Rhythm.
2012;9(8 Suppl):S3-S13.
17. Nagueh SF. Mechanical dyssynchrony in congestive heart failure: diag-
nostic and therapeutic implications. J Am Coll Cardiol. 2008;51(1):18-22.
18. Ghio S, Constantin C, Klersy C, Serio A, Fontana A, Campana C, et al.
Interventricular and intraventricular dyssynchrony are common in heart fai-
lure patients, regardless of QRS duration. Eur Heart J. 2004;25(7):571-8.
19. Galli E, Leclercq C, Donal E. Mechanical dyssynchrony in heart failure:
Still a valid concept for optimizing treatment? Arch Cardiovasc Dis.
2017;110(1):60-8.
20. Hawkins NM, Petrie MC, MacDonald MR, Hogg KJ, McMurray JJ. Selec-
ting patients for cardiac resynchronization therapy: electrical or mecha-
nical dyssynchrony? Eur Heart J. 2006;27(11):1270-81.
21. Pitzalis MV, Iacoviello M, Romito R, Massari F, Rizzon B, Luzzi G, et al.
Cardiac resynchronization therapy tailored by echocardiographic evalua-
tion of ventricular asynchrony. J Am Coll Cardiol. 2002;40(9):1615-22.
22. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS,
et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and
chronic heart failure: The Task Force for the diagnosis and treatment of
acute and chronic heart failure of the European Society of Cardiology
(ESC)Developed with the special contribution of the Heart Failure Asso-
ciation (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200.
23. Cleland JG, Swedberg K, Follath F, Komajda M, Cohen-Solal A,
Aguilar JC, et al. The EuroHeart Failure survey programme-a survey on
the quality of care among patients with heart failure in Europe. Part 1:
patient characteristics and diagnosis. Eur Heart J. 2003;24(5):442-63.
24. Marek J, Gandalovicova J, Kejrova E, Psenicka M, Linhart A, Palecek T.
Echocardiography and cardiac resynchronization therapy. Cor et Vasa.
2016;58: e340-e351
25. Chung ES, Leon AR, Tavazzi L, Sun JP, Nihoyannopoulos P, Merlino J,
et al. Results of the Predictors of Response to CRT (PROSPECT) trial.
Circulation. 2008;117(20):2608-16.
26. Cleland JG, Freemantle N, Erdmann E, Gras D, Kappenberger L, Tava-
zzi L, et al. Long-term mortality with cardiac resynchronization therapy in
the Cardiac Resynchronization-Heart Failure (CARE-HF) trial. Eur J Heart
Fail. 2012;14(6):628-34.
27. Zareba W, Klein H, Cygankiewicz I, Hall WJ, McNitt S, Brown M, et al.
Effectiveness of Cardiac Resynchronization Therapy by QRS Morpholo-
gy in the Multicenter Automatic Defibrillator Implantation Trial-Cardiac
Resynchronization Therapy (MADIT-CRT). Circulation.
2011;123(10):1061-72.
28. Gold MR, Thébault C, Linde C, Abraham WT, Gerritse B, Ghio S, et al.
Effect of QRS duration and morphology on cardiac resynchronization
therapy outcomes in mild heart failure: results from the Resynchronization
Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVER-
SE) study. Circulation. 2012;126(7):822-9.
29. Al-Majed NS, McAlister FA, Bakal JA, Ezekowitz JA. Meta-analysis:
cardiac resynchronization therapy for patients with less symptomatic
heart failure. Ann Intern Med. 2011;154(6):401-12.
30. Beshai JF, Grimm RA, Nagueh SF, Baker JH 2nd, Beau SL, Green-
berg SM, et al. Cardiac-resynchronization therapy in heart failure with
narrow QRS complexes. N Engl J Med. 2007;357(24):2461-71.
31. Naqvi TZ. Echocardiography-guided biventricular pacemaker optimiza-
tion. JACC Cardiovasc Imaging. 2010;3(11):1168-80.
32. European Society of Cardiology (ESC); European Heart Rhythm Asso-
ciation (EHRA), Brignole M, et al. 2013 ESC guidelines on cardiac pacing
and cardiac resynchronization therapy: the task force on cardiac pacing
and resynchronization therapy of the European Society of Cardiology
(ESC). Developed in collaboration with the European Heart Rhythm As-
sociation (EHRA). Europace. 2013;15(8):1070-118.
33. Bradley DJ, Bradley EA, Baughman KL, Berger RD, Calkins H,
Goodman SN, et al. Cardiac resynchronization and death from progres-
sive heart failure: a meta-analysis of randomized controlled trials. JAMA.
2003;289(6):730-40.
34. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, et al.
Cardiac-resynchronization therapy with or without an implantable defibrillator
in advanced chronic heart failure. N Engl J Med. 2004;350(21):2140-50.
35. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenber-
ger L, et al. The effect of cardiac resynchronization on morbidity and
mortality in heart failure. N Engl J Med. 2005;352(15):1539-49.
36. Linde C, Abraham WT, Gold MR, St John Sutton M, Ghio S, Daubert C.
Randomized trial of cardiac resynchronization in mildly symptomatic heart
failure patients and in asymptomatic patients with left ventricular dysfunction
and previous heart failure symptoms. J Am Coll Cardiol. 2008;52(23):1834-43.
37. Moss AJ, Hall WJ, Cannom DS, Klein H, Brown MW, Daubert JP, et al.
Cardiac-resynchronization therapy for the prevention of heart-failure
events. N Engl J Med. 2009;361(14):1329-38.
38. Tang AS, Wells GA, Talajic M, Arnold MO, Sheldon R, Connolly S, et al.
Cardiac-resynchronization therapy for mild-to-moderate heart failure.
N Engl J Med. 2010;363(25):2385-95.
39. Breithardt OA, Stellbrink C, Kramer AP, Sinha AM, Franke A, Salo R,
et al. Echocardiographic quantification of left ventricular asynchrony pre-
dicts an acute hemodynamic benefit of cardiac resynchronization therapy.
J Am Coll Cardiol. 2002;40:536-45.
40. Lindenfeld J, Feldman AM, Saxon L, Boehmer J, Carson P, Ghali JK,
et al. Effects of cardiac resynchronization therapy with or without a defi-
brillator on survival and hospitalizations in patients with New York Heart
Association class IV heart failure. Circulation. 2007;115:204-12.
41. Breithardt G. MADIT-CRT (Multicenter Automatic Defibrillator Implanta-
tion Trial-Cardiac Resynchronization Therapy): cardiac resynchronization
therapy towards early management of heart failure. Eur Heart J.
2009;30(21):2551-3.
42. Sipahi I, Carrigan TP, RowlandDY, Stambler BS, Fang JC. Impact of QRS
duration on clinical event reduction with cardiac resynchronization thera-
py: meta-analysis of randomized controlled trials. Arch Intern Med.
2011;171:1454-62.
43. Sipahi I, Chou JC, Hyden M, Rowland DY, Simon DI, Fang JC. Effect of
QRS morphology on clinical event reduction with cardiac resynchroniza-
tion therapy: meta-analysis of randomized controlled trials. Am Heart J.
2012;163(2):260-7.e3.
44. Strauss DG, Selvester RH, Wagner GS. Defining left bundle branch block
in the era of cardiac resynchronization therapy. Am J Cardiol.
2011;107:927-34.
45. Zabarovskaja S, Gadler F, Braunschweig F, Ståhlberg M, Hörnsten J,
Linde C, et al. Women have better long-term prognosis than men after
cardiac resynchronization therapy. Europace. 2012;14(8):1148-55.
46. Tompkins CM, Kutyifa V, Arshad A, McNitt S, Polonsky B, Wang PJ, et al.
Sex Differences in Device Therapies for Ventricular Arrhythmias or Dea-
th in the Multicenter Automatic Defibrillator Implantation Trial With Car-
diac Resynchronization Therapy (MADIT-CRT) Trial. J Cardiovasc Elec-
trophysiol. 2015;26(8):862-71.
47. Arshad A, Moss AJ, Foster E, et al. Cardiac resynchronization therapy
is more effective in women than in men: the MADIT-CRT (Multicenter
Automatic Defibrillator Implantation Trial with Cardiac Resynchronization
Therapy) trial. J Am Coll Cardiol. 2011;57(7):813-20.
48. Arshad A, Moss AJ, Foster E, Padeletti L, Barsheshet A, Goldenberg I,
et al. Prevention of disease progression by cardiac resynchronization
therapy in patients with asymptomatic or mildly symptomatic left ventri-
cular dysfunction: insights from the European cohort of the REVERSE
(Resynchronization Reverses Remodeling in Systolic Left Ventricular
Dysfunction) trial. J Am Coll Cardiol. 2009;54(20):1837-46.
49. Yin FH, Fan CL, Guo YY, Zhu H, Wang ZL. The impact of gender diffe-
rence on clinical and echocardiographic outcomes in patients with heart
failure after cardiac resynchronization therapy: A systematic review and
meta-analysis. PLoS One. 2017;12(4):e0176248.
50. Dickstein K, Bogale N, Priori S, Auricchio A, Cleland JG, Gitt A, et al.
The European cardiac resynchronization therapy survey. Eur Heart J.
2009;30(20):2450-60.
51. Chatterjee NA, Borgquist R, Chang Y, Lewey J, Jackson VA, Singh JP,
et al. Increasing sex differences in the use of cardiac resynchronization
therapy with or without implantable cardioverter-defibrillator. Eur Heart J.
2017;38(19):1485-94.
52. Wilcox JE, Fonarow GC, Zhang Y, Albert NM, Curtis AB, Gheorghiade M,
et al. Clinical effectiveness of cardiac resynchronization and implantable
cardioverter-defibrillator therapy in men and women with heart failure:
findings from IMPROVE HF. Circ Heart Fail. 2014;7(1):146-53.
53. AlTurki A, Roietti R, Alturki H, Dorian P, Healey J, Greiss I, et al. Outco-
mes of cardiac resynchronization therapy in elderly patients with heart
failure and reduced left ventricular ejection fraction: a meta-analysis. Can
J Cardiol. 2017;10:S155-S156.
54. Olechowski B, Sands R, Zachariah D, Andrews NP, Balasubra-
maniam R, Sopher M, et al. Is cardiac resynchronization therapy feasible,
safe and beneficial in the very elderly? J Geriatric Cardiol. 2015;15(5):
497-501.
55. Evgeny NM, Lebedev DS. Cardiac resynchronization in the elderly is
beneficial, but could we implant our devices in older patients safer? J
Geriatic Cardiol. 2016;13(3):277-8.
56. Mabo P, Laviolle B, Leclerq C, Cesari O, Freemantle N, Verboven Y,
et al. Cardiac resynchronization therapy in elderly patients: outcome data.
A secondary analysis of CARE-HF. Eur Heart J. 2008;29:3.
57. Cacciatore F, Abete P, Mazzella F, Viati L, Della Morte D, D’Ambrosio D,
et al. Frailty predicts long-term mortality in elderly subjects with chronic
heart failure. Eur J Clin Invest. 2005;35(12):723-30.
58. Kubala M, Guédon-Moreau L, Anselme F, Klug D, Bertaina G, Traullé S,
et al. Utility of frailty assessment for elderly patients undergoing cardiac
resynchronization therapy. JACC Clin Electrophysiol. 2017;3:1523-33.
59. European Society of Cardiology (ESC); European Heart Rhythm Asso-
ciation (EHRA); Brignole M, Auricchio A, Baron-Esquivias G,
Bordachar P, Boriani G, Breithardt OA, et al. 2013 ESC Guidelines on
cardiac pacing and cardiac resynchronization therapy. The Task Force
on cardiac pacing and resynchronization therapy of the European Socie-
ty of Cardiology (ESC). Developed in collaboration with the European
Heart Rhythm Association (EHRA). Eur Hear J. 2013;34:2281-329.
60. Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G,
Breithardt OA, et al. Prognostic value of the presence and development
of atrial fibrillation in patients with advanced chronic heart failure. Eur
Heart J. 2000;21(15):1238-45.
61. Wilton SB, Leung AA, Ghali WA, Faris P, Exner DV. Outcomes of cardiac
resynchronization therapy in patients with versus without atrial fibrillation:
a systematic review and meta-analysis. Heart Rhythm. 2011;8(7):1088-94.
62. Healey JS, Hohnloser SH, Exner DV, Birnie DH, Parkash R, Connolly SJ,
et al. Cardiac resynchronization therapy in patients with permanent atrial
fibrillation: results from the Resynchronization for Ambulatory Heart Fai-
lure Trial (RAFT). Circ Heart Fail. 2012;5(5):566-70.
63. Linde C, Leclercq C, Rex S, Garrigue S, Lavergne T, Cazeau S, et al.
Long-term benefits of biventricular pacing in congestive heart failure:
results from the MUltisite STimulation in cardiomyopathy (MUSTIC)
study. J Am Coll Cardiol. 2002;40(1):111-8.
64. Curtis AB, Worley SJ, Adamson PB, Chung ES, Niazi I, Sherfesee L,
et al. Biventricular pacing for atrioventricular block and systolic dysfunc-
tion. N Engl J Med. 2013;368(17):1585-93.
65. Brignole M, Botto G, Mont L, Iacopino S, De Marchi G, Oddone D, et al.
Cardiac resynchronization therapy in patients undergoing atrioventricular
junction ablation for permanent atrial fibrillation: a randomized trial. Eur
Heart J. 2011;32(19):2420-9.
66. Cecchin F, Frangini PA, Brown DW, Fynn-Thompson F, Alexander ME,
Triedman JK, et al. Cardiac resynchronization therapy (and multisite
pacing) in pediatrics and congenital heart disease: five years experience
in a single institution. J Cardiovasc Electrophysiol. 2009;20(1):58-65.
67. van der Hulst AE, Delgado V, Blom NA, van de Veire NR, Schalij MJ,
Bax JJ, et al. Cardiac resynchronization therapy in paediatric and con-
genital heart disease patients. Eur Heart J. 2011;32(18):2236-46.
68. Bacha EA, Zimmerman FJ, Mor-Avi V, Weinert L, Starr JP, Sugeng L,
et al. Ventricular resynchronization by multisite pacing improves myocar-
dial performance in postoperative single-ventricle patient. Ann Thorac
Surg. 2004;78(5):1678-83.
69. Motonaga KS, Dubin AM. Cardiac resynchronization therapy for pediatric
patients with heart failure and congenital heart disease: a reappraisal of
results. Circulation. 2014;129(18):1879-91.
70. Labombarda F, Blanc J, Pellissier A, Stos B, Gaillard C, Bajolle F, et al.
Health-e-Child Project: mechanical dyssynchrony in children with dilated
cardiomyopathy. J Am Soc Echocardiogr. 2009;22(11):1289-95.
71. Janousek J, Gebauer RA, Abdul-Khaliq H, Turner M, Kornyei L, Groll-
muss O, et al. Cardiac resynchronization therapy in pediatric and conge-
nital heart disease: differential effects in various anatomical and functio-
nal substrates. Heart. 2009;95(14):1165-71.
72. Dubin AM, Janousek J, Rhee E, Strieper MJ, Cecchin F, Law IH, et al.
Resynchronization therapy in pediatric and congenital heart disease pa-
tients: an international multicenter study. J Am Coll Cardiol.
2005;46(12):2277-83.
73. European Heart Rhythm Association (EHRA); European Society of Car-
diology (ESC); Heart Rhythm Society. 2012 EHRA/HRS expert consen-
sus statement on cardiac resynchronization therapy in heart failure: im-
plant and follow-up recommendations and management. Europace.
2012;14(9):1236-86.
74. Hosseini SM, Moazzami K, Rozen G, Vaid J, Saleh A, Heist KE, et al.
Utilization and in-hospital complications of cardiac resynchronization the-
rapy: trends in the United States from 2003 to 2013. Eur Heart J.
2017;38(27):2122-8.
75. Yu CM, Hayes DL. Cardiac resynchronization therapy: state of the art
2013. Eur Heart J. 2013;34(19):1396-403.
76. Tolosana JM, Brugada J. Optimizing Cardiac Resynchronization Therapy
Devices in Follow-up to Improve Response Rates and Outcomes. Card
Electrophysiol Clin. 2019;11(1):89-98.
77. Koplan BA, Kaplan AJ, Weiner S, Jones PW, Seth M, Christman SA.
Heart failure decompensation and all-cause mortality in relation to per-
cent biventricular pacing in patients with heart failure: is a goal of 100%
biventricular pacing necessary? J Am Coll Cardiol. 2009;53(4):355-60.
78. Dubner S, Auricchio A, Steinberg JS, Vardas P, Stone P, Brugada J, et al.
ISHNE/EHRA expert consensus on remote monitoring of cardiovascular
implantable electronic devices (CIEDs). Europace. 2012;14(2)
:278-93.
79. Wilkoff BL, Auricchio A, Brugada J, Cowie M, Ellenbogen KA, Gillis AM,
et al. HRS/EHRA Expert Consensus on the Monitoring of Cardiovascular
Implantable Electronic Devices (CIEDs): description of techniques, indi-
cations, personnel, frequency and ethical considerations: developed in
partnership with the Heart Rhythm Society (HRS) and. Europace.
2008;10(6):707-25.
80. Slotwiner D, Varma N, Akar JG, Annas G, Beardsall M, Fogel RI, et al.
HRS Expert Consensus Statement on remote interrogation and monito-
ring for cardiovascular implantable electronic devices. Hear Rhythm.
2015;12(7):e69-e100.
81. Parthiban N, Esterman A, Mahajan R, Twomey DJ, Pathak RK, Lau DH,
et al. Remote Monitoring of Implantable Cardioverter-Defibrillators:
A Systematic Review and Meta-Analysis of Clinical Outcomes. J Am Coll
Cardiol. 2015;65(24):2591-600.
82. García-Fernández FJ, Osca Asensi J, Romero R, Fernández Lozano I,
Larrazabal JM, Martínez Ferrer J, et al. Safety and efficiency of a com-
mon and simplified protocol for pacemaker and defibrillator surveillance
based on remote monitoring only: a long-term randomized trial (RM-ALO-
NE). Eur Heart J. 2019;40(23):1837-46.
83. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH,
et al. 2013 ACCF/AHA guideline for the management of heart failure: a
report of the American College of Cardiology Foundation/American Heart
Association Task Force on Practice Guidelines. J Am Coll Cardiol.
2013;62(16):e147-e239.
84. van der Meer P, Gaggin HK, Dec GW. ACC/AHA Versus ESC Guidelines
on Heart Failure: JACC Guideline Comparison. J Am Coll Cardiol.
2019;73(21):2756-68.